Supplemente begleiten die Geschichte des Kraftsports seit mehr als vierzig Jahren. Besonders Eiweißpulver und Aminosäuren sind inzwischen aus dem Kraftsport nicht mehr wegzudenken. Die Forschung bestätigte mehr als einmal, dass die ausreichende Versorgung mit Eiweißen das Fundament jedes Masse- sowie Kraftzuwachses bildet. Aminosäuren, die kleinsten Bausteines jedes Muskelproteins, gelten aus diesem Grund als optimale Ergänzung. Experten unterstreichen dabei immer wieder die Bedeutung der essentiellen Aminosäuren (EAA – Essential Amino Acids). In diesem Artikel werden die Vorteile von EAAs ausführlich geschildert.
Die „richtigen“ Nährstoffe
Wer groß und stark werden will, der muss viel essen. Dieser großelterlichen Weisheit sind wohl die wenigsten Kinder entgangen, wenn das Essen einmal nicht schmeckte. Dabei ist sie falsch. Wichtig ist nicht die Menge des Essens, sondern die Art der Nährstoffe. Schließlich würde niemand „groß und stark“ werden, wenn dreimal täglich Schokolade auf dem Speiseplan stünde. Bei der falschen Ernährung bringen selbst die intensivsten Trainingseinheiten nichts. Der Körper kann aus Zucker keine Muskelproteine synthetisieren. Das kann er lediglich aus Aminosäuren.
Doch Aminosäuren sind nicht gleich Aminosäuren. Seit Jahrzehnten herrscht eine hitzige Debatte über die Wirkung der Muskelbausteine. Insbesondere bei der Wirkung von BCAAs und EAAs scheiden sich die Geister.

Was sind BCAAs und EAAs?
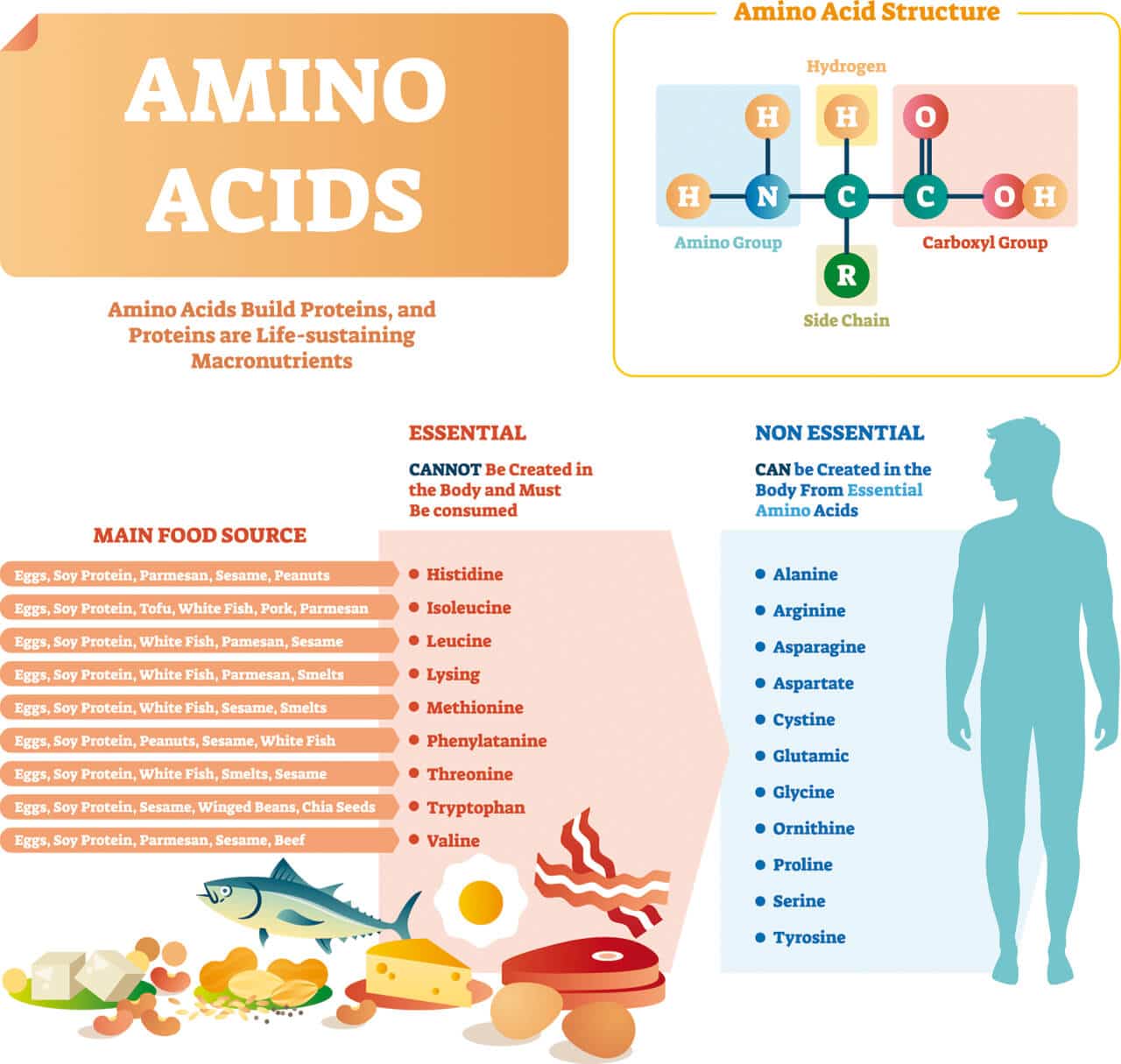
Beide Begriffe bezeichnen essentielle Aminosäuren. Der Körper kann essentielle Aminosäuren nicht herstellen, wodurch sie über die Nahrung zugeführt werden müssen. Bei intensiven körperlichen Belastungen steigt der Bedarf an essentiellen Aminosäuren. „BCAA“ ist ein englischsprachiger Begriff und steht für verzweigtkettige Aminosäuren (Branched-Chain Amino Acids). Die Supplemente enthalten die Aminosäuren Leucin, Isoleucin und Valin in einem Verhältnis von 2:1:1, 4:1:1 oder 8:1:1 (Leucin:Valin:Isoleucin).
Der Begriff „EAA“ steht für die acht essentiellen Aminosäuren im Speziellen. Dazu zählen: Isoleucin, Leucin, Lysin, Methionin, Phenylalanin, Threonin, Tryptophan und Valin. In bestimmten Situationen reicht die Eigenproduktion an Histidin und Arginin nicht aus. Sie gelten daher als semi-essentiell.
BCAAs vs. EAAs – ein kurzer Blick in die Debatte
BCAAs galten vor wenigen Jahren als Alleskönner. Ein Supplement, dass Kraftsportler am besten vor, während und nach dem Training zu sich nahmen. Das Verhältnis der Aminosäuren ist mit 2:1:1 an das der drei Aminosäuren in der Muskulatur von 1,8:1:1 angepasst. Da der Körper BCAAs nicht in der Leber verstoffwechselt, können sie sofort von den Muskelzellen aufgenommen werden. Die Bedingungen für einen anabolen, also aufbauenden, Effekt sind somit (theoretisch) optimal. Es gibt nur ein Problem.
Doch vorher ein kurzer Blick in die Muskelzellen:
Damit der Blick in die Debatte klarer wird, muss verstanden sein, wie Muskelwachstum funktioniert: Beim Training entstehen kleine Risse in der Muskulatur. Diese Risse entstehen nicht in den Muskelfasern oder -bündeln, sondern in den Mikrofilamenten. Mikrofilamente werden aus den Proteinen Aktin und Myosin gebildet, die zusammen lange Proteinfäden formen. Muskelwachstum entsteht dadurch, dass die Mikrofilamente während des Trainings beschädigt werden. Die kleinen Risse werden anschließend mit neuen Proteinen repariert, sodass der Muskel größer und stärker wird.
Nun zum Problem: Über die Wirkung von BCAAs streiten sich die Wissenschaftler, da die Studienlage uneinheitlich ist. In einigen Studien konnten positive Effekte nachgewiesen werden.[2][3] Kritiker bemängeln jedoch entweder das Studiendesign oder die Anzahl der Teilnehmer. Der Amerikaner Dr. Robert R. Wolfe, gilt als Experte auf dem Feld des menschlichen Stoffwechsels. Im Jahr 2017 veröffentlichte die renommierte Fachzeitschrift „Journal of the International Society of Sports Nutrition“ ein Papier des Wissenschaftlers.[4] In seiner Arbeit kommt er zu dem Schluss, dass BCAAs die Muskelproteinsynthese nicht stimulieren.
Dr. Robert R. Wolfe verweist darauf, dass für den Aufbau der Muskelproteine die anderen essentiellen Aminosäuren ebenfalls benötigt werden. Diese werden dadurch bereitgestellt, dass Proteine abgebaut werden. Circa 70 Prozent, der durch Abbau gewonnenen EAAs, werden wiederum für die Synthese von Muskelproteinen verwendet. Da die 70-Prozent-Rate nicht maßgeblich erhöht werden kann und die Protein-Kapazität der Muskelzellen begrenzt ist, beeinflussen BCAAs die Muskelproteinsynthese nicht.
In dem Fazit betont er stattdessen die Rolle der EAAs: „Eine physiologisch signifikante Erhöhung der Rate der Muskelproteinsynthese erfordert eine ausreichende Verfügbarkeit aller Aminosäuren.“
Die EAAs und ihre Rolle beim Muskelaufbau
Wie der amerikanische Wissenschaftler Dr. Wolfe in seiner Arbeit betonte, braucht der Körper alle essentiellen Aminosäuren für den Muskelaufbau. Wie jede der acht EAAs den Muskelaufbau beeinflusst, wird in diesem Abschnitt erklärt.
Methionin
Methionin ist eine schwefelhaltige Aminosäure, die zahlreiche biochemische Abläufe im Körper reguliert. Es ist bekannt für seine schützende Wirkung auf die Blutgefäße. Es unterstützt den Fettstoffwechsel, wodurch sich weniger Fette in den Blutgefäßen ansammeln. Daneben hat Methionin antioxidative Eigenschaften und schützt Gewebe vor den Schäden oxidativen Stresses.
Den Muskelaufbau beeinflusst Methionin, indem es ein wichtiger Bestandteil der Proteinbiosynthese ist. Die Translation, die Synthese von Proteinen nach den Vorgaben der Gene, beginnt mit Methionin. Nach der Synthese des Proteins wird die Aminosäure wieder abgetrennt. Nicht benötigtes, freies Methionin funktioniert wiederum als Spender für Methylgruppen. Dadurch beeinflusst Methionin die Bildung lebensnotwendiger Stoffe wie Kreatin, Adrenalin, Cholin und Melatonin.
Methionin und Lysin sind wichtig, damit der Körper L-Carnitin herstellen kann. L-Carnitin verbessert wiederum die Regeneration und hemmt die Bildung von Lactat.[5] Daneben verbessert L-Carnitin die Verwertung von Kreatin.
Lysin
Die Aminosäure Lysin beeinflusst den Erhalt und den Aufbau von Muskelmasse. Es ist an der Proteinbiosynthese beteiligt und daher für die Synthese von Proteinen notwendig. Wie weiter oben erläutert, ist Lysin und Methionin an der Bildung von L-Carnitin beteiligt, welches die Regeneration der Muskeln verbessert.
Arginin und Lysin haben einen synergistischen Effekt auf die Erhöhung des Wachstumshormons Somatropin. Schon 1981 wurde eine Studie zu dem Thema veröffentlicht.[6] Bei den männlichen Versuchsteilnehmern erhöhte eine Kombination aus 1,200 mg Lysin und 1,200 mg Arginin die Sekretion des Wachstumshormons. Die Ergebnisse dieser Studie sind umstritten, da in nachfolgenden Studien der Effekt nicht bestätigt werden konnte.[7] Neuere Studien zeigen jedoch eine positive Wirkung von Aminosäuren im Allgemeinen auf Somatropin.[8]
Da Lysin die Aufnahme von Calcium beeinflusst, leiden die Knochen unter einem Mangel. Dadurch kann der altersbedingte Abbau von Knochenmasse eine Osteoporose begünstigen.
Valin
Aufgrund seiner verzweigten Struktur kann die Aminosäure Valin nicht vom Körper hergestellt werden. Daher muss sie über die Nahrung zugeführt werden. Alle wichtigen Proteine des menschlichen Körpers bestehen zu fünf bis acht Prozent aus Valin.
Strukturell ähnelt die Aminosäure Isoleucin und Leucin. Nach derzeitigem Forschungsstand hat die alleinige Aufnahme von Valin keinen signifikanten Effekt auf die Muskelproteinsynthese. Die Wirkung ist schwächer als die von Isoleucin und Leucin. Beispielsweise kann Valin die Glykogensynthese in Muskelzellen ankurbeln, wirkt aber deutlich schwächer als Isoleucin.[9]
In einer Tierstudie konnte ein positiver Effekt von Valin auf „mTor“ nachgewiesen werden.[10] „mTor“ ist ein Enzym, welches anabole Prozesse steuert. Eine höhere Aktivität des Enzyms ist ein Indikator für anabole Prozesse.
Leucin
Leucin ist die Aminosäure, deren Wirkung auf dem Muskelaufbau am häufigsten untersucht wurde. Die Aminosäure gilt als Energielieferant für die Muskelzellen. Daneben aktiviert Leucin das Enzym „mTor“, welches wiederum die Muskelproteinsynthese anregt.[11] Die Synthese der Muskelproteine kann durch Leucin nicht unendlich gesteigert werden, sondern stagniert bei einer bestimmten Rate.[12]
Interessanterweise stimuliert Leucin die Sekretion von Insulin.[13] Mehr Insulin bedeutet wiederum, dass mehr Nährstoffe in die Muskelzellen gelangen und so mehr Muskelproteine gebildet werden können.
Isoleucin
Gemeinsam mit Leucin und Valin gehört Isoleucin zu den verzweigtkettigen Aminosäuren. In Bezug auf die Muskelproteinsynthese wirkt Isoleucin stärker als Valin, aber schwächer als Leucin. Obwohl Isoleucin die Synthese von Glucose nicht verändert, verbessert es deren Aufnahme. Eine japanische Studie konnte nachweisen, dass Isoleucin die Aufnahme der Muskelzellen von Glucose dosisabhängig erhöht.[14] Daneben erhöht Isoleucin die Insulinausschüttung der Bauchspeicheldrüse, wodurch mehr Aminosäuren in die Muskelzellen gelangen.
Phenylalanin
Phenylalanin ist eine proteinogene Aminosäure, die für die Synthese von Proteinen im Körper verwendet wird. Es wird beispielsweise benötigt, um Insulin, Tyrosin, Melanin, sowie das Schilddrüsenhormon Thyroxin herzustellen.
Phenylalanin wird beim Fasten ausgeschüttet. Dann hemmt es die Aktivität von „mTor“ und somit den Aufbau neuen Gewebes.[15] Zudem konnten Wissenschaftler einen positiven Effekt von Phenylalanin auf die Fettverbrennung nachweisen.[16]
Tryptophan
Tryptophan ist eine der bekanntesten Aminosäuren, da sie für die Bildung des Glückshormons (Serotonin) und des Schlafhormons (Melatonin) benötigt wird. Somit spielt die Aminosäure eine große Rolle bei der Regulierung von Schlaf, Sexualität, Stimmung, Appetit und Stoffwechsel.
Die Wirkung von Tryptophan auf den Muskelaufbau wurde noch nicht erforscht. Es beeinflusst jedoch die Stimmung und dadurch die Motivation sowie den Schlaf und somit die Regeneration. Sportler, die ihren Serotoninspiegel und somit ihre Stimmung verbessern wollen, sollten Tryptophan zuführen. Befindet sich zu wenig Tryptophan im Gehirn, wird zu wenig Serotonin produziert und es kann zu depressiven Symptomen kommen.
Threonin
Threonin erlangte Bekanntheit als der amerikanische Biochemiker William Cumming Rose in den 1930er Jahren Versuche mit Ratten durchführte. Er fütterte die Tiere mit Nahrung, die eine Kombination aus 19 verschiedenen Aminosäuren enthielt.
Er stellte jedoch fest, dass die Tiere nicht wuchsen. Erst nachdem er Threonin entdeckte und hinzufügte, wuchsen die Ratten. Das zeigt, wie wichtig die Aminosäure für das Wachstum ist. In einigen Tierstudien konnte gezeigt werden, dass sowohl eine Überversorgung als auch eine Unterversorgung mit Threonin die Proteinsynthese negativ beeinflusst.[17]
Was gibt es bei der Einnahme von EAAs zu beachten?
Um den Trainingserfolg zu maximieren, ist es entscheidend, die richtigen Nährstoffe zum richtigen Zeitpunkt einzunehmen. Je besser die Versorgung mit essentiellen Aminosäuren nach dem Training, desto stärker profitieren die Muskeln davon. Während des Trainings werden neben Glykogen und Fetten auch Proteine verbrannt.
Wenn dem Köper nach dem Training nicht genügend Aminosäuren zur Verfügung stehen, spaltet er vorhandene Eiweiße auf. Somit werden Muskelproteine abgebaut, um den Bedarf zu decken. Die unzureichende Versorgung mit den richtigen Nährstoffen ist einer der häufigsten Gründe, dass Sportler trotz intensiven Trainings keine Muskeln aufbauen.
Sportler profitieren am stärksten von EAAs, wenn sie sie direkt nach dem Training zu sich nehmen. Wenn zusätzlich noch BCAAs eingenommen werden, dann sollten diese vor dem Training und die EAAs nach dem Training verzehrt werden. Da EAAs in Whey Protein enthalten sind, ist eine Kombination von Whey Protein und EAAs nicht immer sinnvoll. Auf die zusätzliche Aufnahme von EAAs sollte dann nur zurückgegriffen werden, wenn zu wenig Eiweiß über den Tag verzehrt wurden.
Die Dosierung der EAAs hängt vom persönlichen Bedarf ab. Als Orientierung sollte die Empfehlung des Herstellers gelten. Diese liegt in der Regel zwischen 10 bis 20 g. EAAs können mit Kohlenhydraten kombiniert werden, um die Insulinausschüttung zu stimulieren. So gelangen die Aminosäuren schneller in die Muskelzellen.
Überdosierung und Nebenwirkungen von EAAs
Es gibt keine Berichte über Überdosierungen von EAAs. Bei gesundheitlichen Leber- oder Nierenbeschwerden sollte vor dem Verzehr von EAAs ein Arzt konsultiert werden.
Welche Lebensmittel enthalten EAAs?
Lebensmittel, die alle EAAs enthalten, sind: rotes Fleisch, Geflügel, Fisch, Eier, Milchprodukte sowie einige pflanzliche Lebensmittel wie Soja und Quinoa. Daneben gibt es Lebensmittel, die lediglich einige der Aminosäuren enthalten. Cashewkerne sind beispielsweise reich an Tryptophan.
Supplemente als EAA-Lieferant
Neben natürlichen Lebensmitteln beinhalten viele Supplemente EAAs. Die besten Pulver haben wir hier getestet. Daneben befinden sich einige vegane Pulver wie Soja Proteinpulver auf dem Markt, die ebenfalls alle essentiellen Aminosäuren enthalten.
EAAs aus Proteinen wie Whey Protein haben jedoch den Nachteil, dass der Körper die Proteine erst aufspalten muss (Proteolyse). Dabei werden die Proteine zuerst in kleinere Proteine und anschließend in Aminosäuren aufgespalten. Je nach Komplexität des Proteins dauert das Aufspalten länger. EAAs wirken wesentlich schneller als Proteinpulver, da sie nicht aufgespalten werden müssen, sondern direkt in die Muskelzellen gelangen.
Fazit
EAAs sind für Sportler eine optimale Ergänzung nach dem Training. Die Aminosäuren unterstützen die Muskelproteinsynthese und somit den Muskelaufbau. Sportler, die zu wenig Eiweiß über die Ernährung aufnehmen, profitieren am stärksten von EAAs.
Studien und Quellen:
(1) https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4897441
(2) https://jissn.biomedcentral.com/articles/10.1186/1550-2783-6-S1-P1
(3) https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4241904/
(4) https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5568273/
(5) https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6343764/
(6) https://www.ncbi.nlm.nih.gov/pubmed/6790230
(7) https://www.ncbi.nlm.nih.gov/pubmed/8315224
(8) https://www.ncbi.nlm.nih.gov/pubmed/30893070
(9) https://www.ncbi.nlm.nih.gov/pubmed/14651987
(10) https://www.ncbi.nlm.nih.gov/pubmed/20832409
(11) https://www.ncbi.nlm.nih.gov/pubmed/11015466
(12) https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2488337/
(13) https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3397906/
(14) https://www.ncbi.nlm.nih.gov/pubmed/14651987
(15) https://www.ncbi.nlm.nih.gov/pubmed/25020061
(16) https://jissn.biomedcentral.com/articles/10.1186/s12970-017-0191-x
(17) https://academic.oup.com/jn/article/137/6/1442/4664791